 第Ⅱ期 次世代プロジェクト
Future Projects(2023/4~)
第Ⅱ期 次世代プロジェクト
Future Projects(2023/4~)
- ヒトiPS細胞由来心筋組織の構築に資する高性能足場材の探索と心疾患治療への応用
- 自己免疫疾患の抗原特異性の詳細解析による疾患制御法の確立
- 皮膚微生物叢と宿主の相互作用の理解と、皮膚疾患発生機序の解明
- 自己免疫疾患における新たな抗原特異的制御法の確立
- 組織再生医療研究を加速させる足場材の開発と応用
- 臓器間ネットワークを介した肝線維化進展・修復機序の解明
ヒトiPS細胞由来心筋組織の構築に資する高性能足場材の探索と心疾患治療への応用
ヒトiPS細胞由来心筋組織の構築に資する高性能足場材の探索と心疾患治療への応用背景
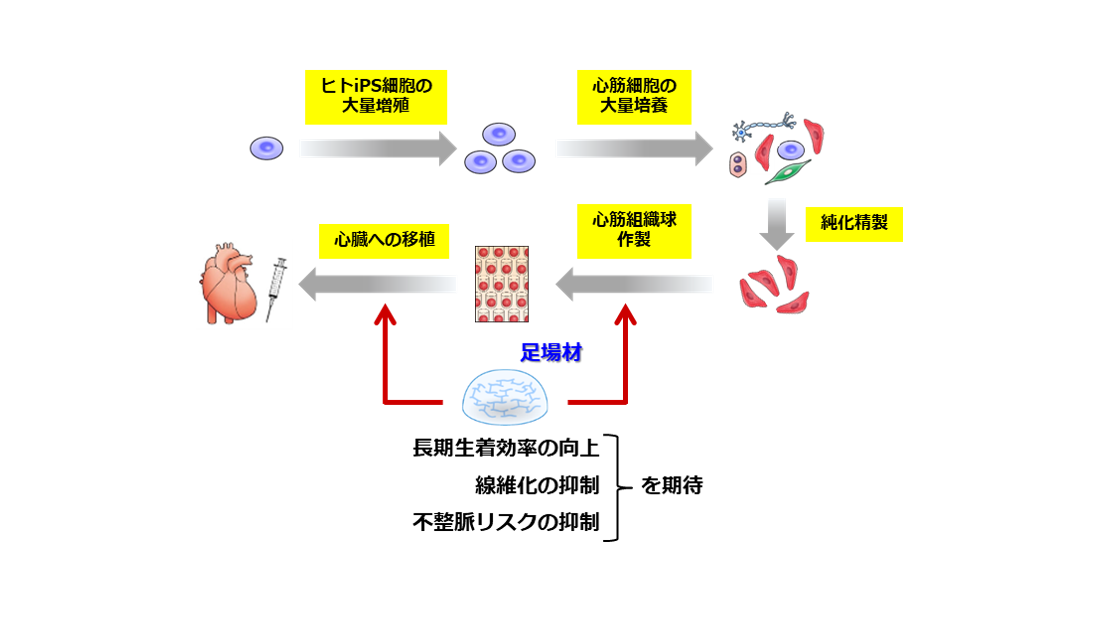
心臓移植は現在のところ重症心不全に対する唯一の根本的治療法だが、深刻なドナー不足から標準的な治療法となり得ていない。再生医療は代替法として有力なアプローチの一つであり、特にヒトiPS細胞はその細胞源として期待されている。研究代表者の遠山らは、ヒトiPS細胞を用いた心臓再生医療の実現を目指し、ヒトiPS細胞の樹立・増殖促進から心筋細胞の大量作製・精製、さらには心筋組織球の形成とその移植に至るまで、一連の技術を構築してきた。一方で、移植における心筋細胞の生着効率や催不整脈作用の抑制には未だ改善すべき点があり、治療の実現に向けた課題として残されている。
目的
上記の課題に対して、移植組織における微小血管の構築促進と成熟度の向上が有効との仮説のもとで進められた研究から、移植における足場材の重要性が見出されている。左記を踏まえて本研究では、JKiCで共同開発中の足場材をヒトiPS細胞由来心筋組織球の移植に適用することで、細胞移植治療における問題点の解消に貢献し、心臓再生医療における有用な足場材の開発に繋がる成果を得ることを目的としている。
□
自己免疫疾患の抗原特異性の詳細解析による疾患制御法の確立
自己免疫疾患の抗原特異性の詳細解析による疾患制御法の確立背景
自己免疫疾患は、リンパ球などの免疫細胞が自己を攻撃することで発症する疾患の総称であり、患者血清中に自己抗体が存在することが一つの特徴である。この自己抗体は、種類の判別により疾患の表現型や治療反応性含めた予後まで推測でき、さらに、一部の自己抗体の量は疾患活動性にも関連するため、自己抗体の出現が疾患の病態に関連していることは間違いない。
慶應義塾大学医学部リウマチ膠原病内科では伝統的に自己抗体研究を行ってきており、発見された多くの自己抗体が体外診断用医薬品にも使用されている。研究対象の一つにシェーグレン症候群があり、自己抗体を研究の手掛かりとして、疾患による変化が最も顕著に表れる病変部位に着目した研究を進めてきた。しかし、他の多くの自己免疫疾患同様に、明確な病因が定まっておらず、治療は汎免疫抑制療法が中心であり、感染症をはじめとする薬剤の副作用が問題となっている。
目的
これまでの研究により、シェーグレン症候群患者の病変部位には自己反応性B細胞が浸潤し、自己免疫反応を起こしている事が明らかになってきた。本研究では、リウマチ膠原病内科が積み上げてきたシェーグレン症候群研究の知見を土台とし、JSRグループが保有する先端バイオテクノロジー技術を駆使して、病因の解明、さらには抗原特異的な免疫抑制療法やそれに伴うコンパニオン診断薬開発を目指している。
□
皮膚微生物叢と宿主の相互作用の理解と、皮膚疾患発生機序の解明
皮膚微生物叢と宿主の相互作用の理解と、皮膚疾患発生機序の解明背景
ヒトの皮膚には様々な種類の微生物が棲息しており、肌の生理状態(水分量、皮脂量、炎症の有無、等)や、構造(角質層の厚さ、状態、ターンオーバーの頻度、等)によって優勢となる微生物群が異なるニッチを形成している。また、これらの皮膚常在微生物群は、菌同士または宿主との相互作用を介して、様々な皮膚疾患の発症、増悪・寛解など病態の変化等と関連していることが報告されているが、その詳細については未だ明らかにされていない部分が大きい。
目的
私たちの研究グループでは、臨床から得られたヒト皮膚微生物検体を詳細に解析することで、病態との関わりを明らかにし、また微生物群と宿主、微生物どうしの相互関係を理解することでその機序を明らかにし、皮膚微生物叢をターゲットとした新たなモダリティの創薬を目指して研究に取り組んでいる。
□
自己免疫疾患における新たな抗原特異的制御法の確立
自己免疫疾患における新たな抗原特異的制御法の確立背景
天疱瘡はIgG型自己抗体が誘導する自己免疫性水疱性疾患の一つである。その標的抗原であるデスモグレインは表皮角化細胞の細胞接着を担うタンパク質である。天疱瘡患者ではデスモグレインに対する自己抗体により、この細胞接着機能が障害され、病理学的に棘融解とよばれる水疱が表皮内に出現する。現状の治療は、ステロイドや免疫抑制剤、リツキシマブが使用されるが、その免疫抑制効果は抗原非特異的であり、標的抗原が同定された天疱瘡であっても未だに抗原特異的な治療法は臨床応用されていない。本プロジェクトでは、天疱瘡の病態を抗原特異的な免疫細胞に注目して詳細に解析し、将来の抗原特異的治療法の確立を目指す。
目的
慶應義塾大学医学部皮膚科では長年にわたって、天疱瘡に対するより良い最先端の治療とその病態解明を目指した研究を重ねてきた。特に天疱瘡モデルマウスを開発し、抗原特異的な解析を通じて、詳細な免疫学研究を進めてきている。この知見にJSRグループ保有の最先端技術を組み合わせることで、病気を引き起こす免疫細胞の検出を目指している。病院的な免疫細胞の特性を分子レベルで明らかにさせることにより、抗原特異的な治療法の開発を目指す。特に、マウスモデルを用いて、抗原特異的治療法のコンセプトを確立し、人への応用の可能性について検証を行っていく。
本プロジェクトを達成することにより、今まで知られていない、全く新しい治療戦略を提示し、天疱瘡だけでなく、多くの自己免疫疾患の治療に応用できるような技術の開発を目指していきたい。
□
組織再生医療研究を加速させる足場材の開発と応用
組織再生医療研究を加速させる足場材の開発と応用背景
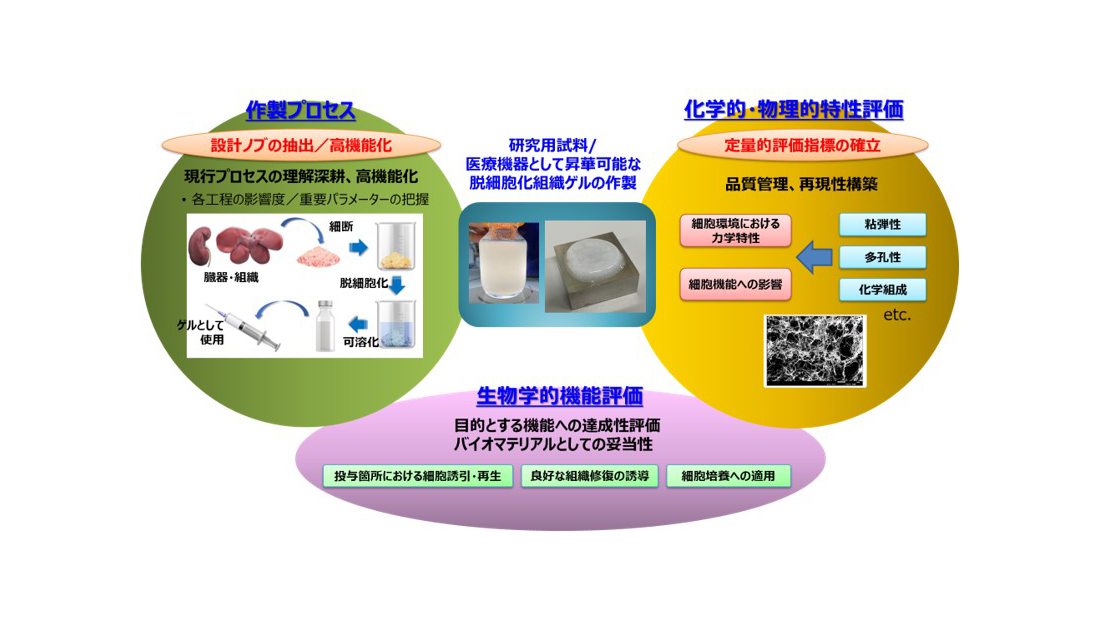
近年の再生医療研究の発展はめざましく、学術・実用の両面で疾患モデルや創薬研究で優れた成果を創出しつつある。一方でその臨床応用は、社会的期待とは裏腹に実現が遅れている。その大きな原因として、移植後の周囲環境による物理的・免疫学的ストレスや血流不足等によって、移植部の細胞の安定した長期生着が得られず、その結果として組織・臓器として充分な機能を発現できないことが、最大の障壁となっている。
目的
細胞の生着・機能発現に適した環境を提供するのは、再生医療の三大要素にも挙げられる足場の役割である。足場材は上記の各種ストレスや血流不足を補うほか、内部での効率的な細胞移動を促して体内での安定的な生着に寄与し、また自然に自己組織化することも求められる。研究代表者の八木らは、動物臓器・組織を脱細胞化することで得られる「脱細胞化組織」とそのゲル化材が上記の要素を複数併せ持ち、足場材として優れた特性を示すことを明らかにしてきた。本研究ではその実用化を目指し、①作製プロセスの最適化、②品質・特性の把握、③特性と機能との紐づけ、を行い、機能においては特に線維化に対する効果に注目して検討する。
□
臓器間ネットワークを介した肝線維化進展・修復機序の解明
臓器間ネットワークを介した肝線維化進展・修復機序の解明背景
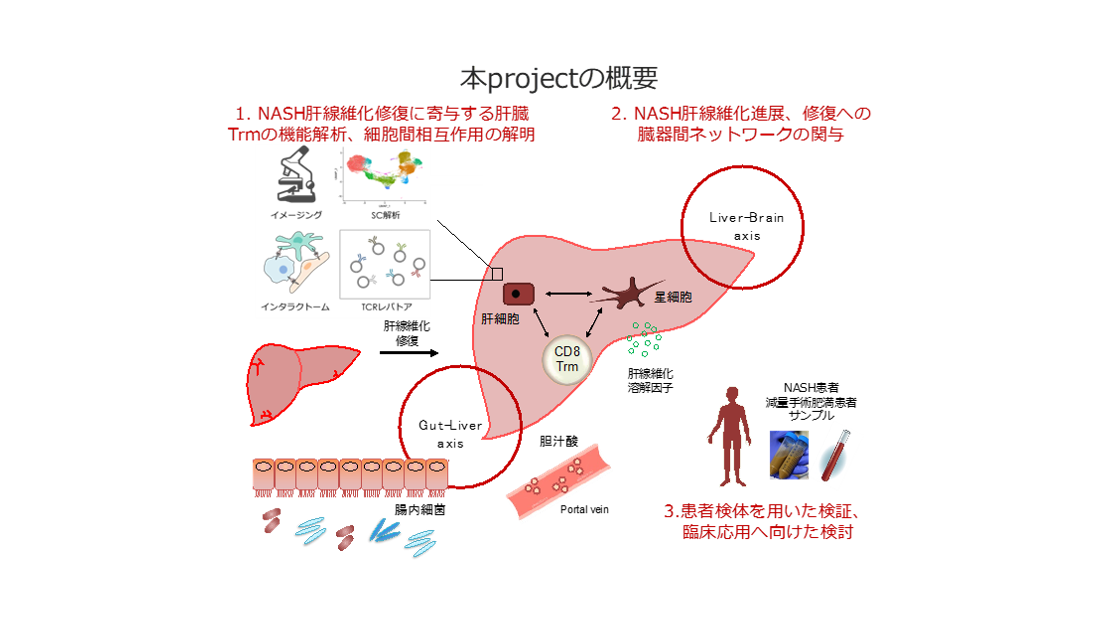
食生活の西洋化と運動不足に伴い、近年日本国内で肥満や生活習慣病を基盤とする肝障害であるNAFLD(Nonalcoholic fatty liver disease; 非アルコール性脂肪性肝疾患)やNASH(Nonalcoholic steatohepatitis; 非アルコール性脂肪性肝炎)が増加している。NASHの進行により、他のウイルス性肝疾患と同様に肝線維化、肝硬変への進展や肝臓癌(肝細胞癌 Hepatocellular carcinoma; HCC)の合併が高率に認められる。NASHは生活習慣病の一部として今後さらに増加すると考えられており、早期治療介入が急務である。一方で、NASHに対する治療介入は食事、運動療法が主であり、日本国内で保険適応がある薬物療法はインスリン抵抗性改善薬のピオグリタゾンとビタミンE製剤のみである。
目的
肝線維化はこれまで非可逆的と考えられてきたが近年、様々なアプローチから肝線維化修復機構の存在が明らかになりつつある。研究代表者である中本は、NASH 修復モデルマウスを用いた研究から、記憶免疫細胞の一つであるResident memory T細胞(Trm)が肝線維化修復に根幹的な働きを担うことを新たに見出した。本研究では、前述の先行研究をさらに発展させ、NASH線維化修復を多角的かつ統合的に解析する。この研究を通じて、NASH線維化修復現象を解像度高く理解し、最終的にはNASHに関連した社会実装シーズの創出を目指す。
□

